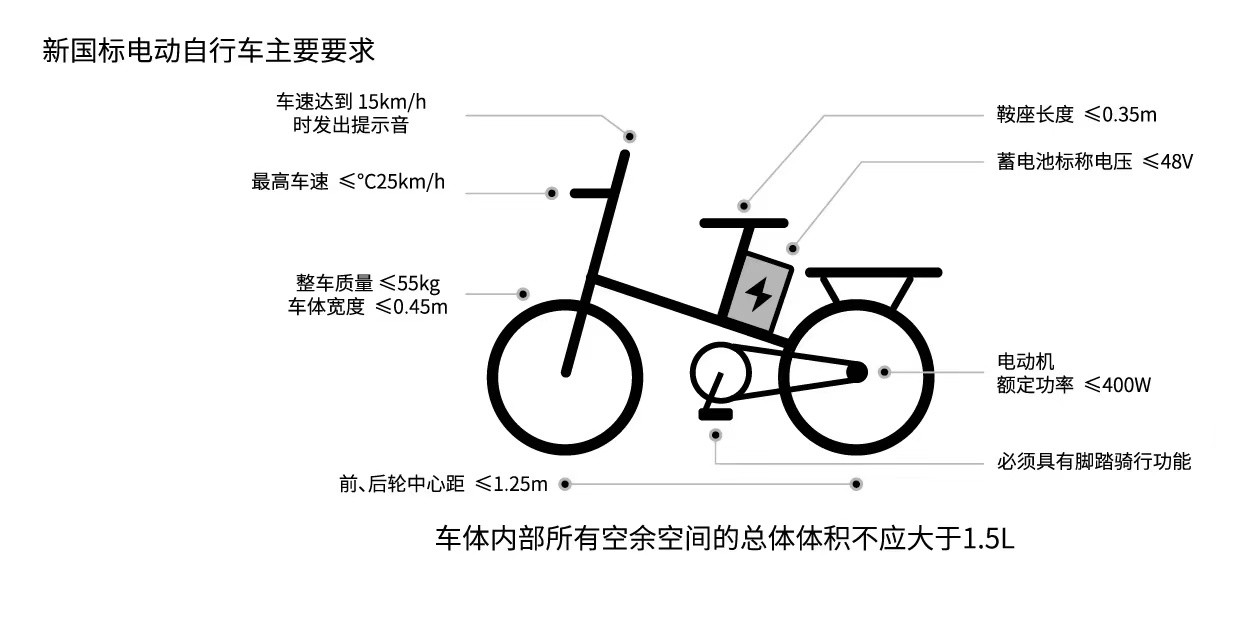
铁矿价格走势_铁氰化钾 每日讯息
1、铁氰化钾是有毒的,它含有铁氰根。
2、铁氰根比亚铁氰根[Fe(CN)6]4–容易发生水合作用而产生氢氰酸,因此有毒。
3、铁氰根离子也能与许多金属形成盐,它的碱金属盐、碱土金属盐溶于水,而其他金属盐通常难溶于水。
 (相关资料图)
(相关资料图)
4、铁氰根与稀硫酸作用产生HCN;与浓硫酸反应时氰根被氧化成一氧化碳。
5、在碱性溶液中铁氰根为强氧化剂,可将三价铬氧化成铬酸根。
6、铁氰根离子还可以形成各种各样的取代形离子[Fe(CN)5X](X为H2O、NO2等),其中最著名的是硝普盐和一亚硝基五氰合铁离子[Fe(CN)5NO]2-。
7、亚铁氰化钾经氯气或电解氧化,可得铁氰化钾K3[Fe(CN)6],为红棕色晶体,也称赤血盐,密度为1.85克/厘米3(25℃);强烈加热会分解;不溶于乙醇,溶于丙酮和水,4℃时在100克水中可溶33克。
8、是铁氰化物中最重要的盐。
9、铁氰化钾与过量的亚铁盐作用,得到结构复杂的滕氏蓝沉淀。
10、铁氰化钾与浓盐酸作用可得铁氰酸H3[Fe(CN)6],为棕黄色针状晶体;50~60℃分解;溶于水、醇,不溶于乙醚;在水溶液中为三元强酸。
11、铁氰化钾是一种无机物,化学式K3[Fe(CN)6],俗称赤血盐、赤血盐钾,分子量为329.24,为红色晶体,可溶于水,水溶液带有黄绿色荧光,含有铁氰根配离子[Fe(CN)6]3−。
12、铁氰化钾由德国化学家利奥波德·格麦林于1822年发现,德国化学家罗伯特·威廉·本生于1846年成功测定铁氰化钾的组成和结晶。
13、主要应用于照相纸、颜料、制革、印刷、制药、肥料、媒染剂、电镀、造纸、钢铁等工业。
14、该物质的中心原子是铁离子(Fe3+),配位体是氰根离子(CN-),配位数为6,内界是铁氰根离子{[Fe(CN)6]3-},外界是钾离子(K+)。
15、有毒。
16、铁氰化钾是一种无机物,俗称赤血盐、赤血盐钾,为红色晶体,可溶于水,水溶液带有黄绿色荧光,含有铁氰根配离子。
17、铁氰化钾在紫外光或日光照射下,或在酸性介质中受热,会分解出剧毒的氢氰酸。
18、您好,铁氰化钾是有毒的,它含有铁氰根。
19、铁氰根比亚铁氰根[Fe(CN)6]4–容易发生水合作用而产生氢氰酸,因此有毒。
20、有毒,但是毒性极低。
本文到此分享完毕,希望对大家有所帮助。
相关阅读
-
铁矿价格走势_铁氰化钾 每日讯息
1、铁氰化钾是有毒的,它含有铁氰根。2、铁氰根比亚铁氰根[Fe(CN)6... -
女大学生“滴滴”偶遇法拉利,竟向车主...
随着科技的不断发展,人们的生活水平越来越好的,现在生活越来越便... -
依兰爱情故事贾玲小品完整_依兰爱情故事...
1、依兰爱情故事讲述一个男人和女人在美好的年纪里相遇了,他们彼此... -
苅字的含义_苅族 司藤
1、《司藤》苅族是电视剧虚构的,实际当中并不存在。2、在《司藤》... -
美股异动 | 小鹏汽车(XPEV.US)一度涨1...
小鹏汽车(XPEV US)公司简介:小鹏汽车创立于2015年,是中国领先... -
轻快灵巧/配置越级 试驾五菱Air ev晴...
五菱推出宏光MINI EV之后,出现了“破圈”的现象,原本是一款价格亲...
- 铁矿价格走势_铁氰化钾 每日讯息2023-01-05
- 女大学生“滴滴”偶遇法拉利,竟向车主提这2023-01-05
- 十堰法院破解执行难题,2022年执行到位46.52023-01-05
- 天天消息!湖北襄阳高新消防开展辖区群租房2023-01-05
- 每日速递:武汉发布2023年春运方案 春运2023-01-05
- 环球百事通!湖北省最大海绵化改造工程沙湖2023-01-05
- 武汉市春运7日开始,预计发送旅客755万人次2023-01-05
- 当前热点-2022“湖北年度十大文艺新闻”评2023-01-05
- 依兰爱情故事贾玲小品完整_依兰爱情故事的2023-01-05
- 苅字的含义_苅族 司藤2023-01-05
- 美股异动 | 小鹏汽车(XPEV.US)一度涨11%2023-01-05
- 轻快灵巧/配置越级 试驾五菱Air ev晴空|2023-01-05
- 2023款奥迪A4L亮相广州车展,外观设计运动2023-01-05
- 淋雨室技术参数及规划管理2023-01-05
- 男子大喊“死神来了”冲击飞机前舱门,亲历2023-01-04
- 当前热点-“研判民警”李永丰:痴迷破案十2023-01-04
- 水晶冰糖和黄冰糖有什么区别_水晶冰糖2023-01-04
- 马自达最本土化的SUV来了!CX-50能够翻身成2023-01-04
- 天天热门:国造超高清4K转播车完成中超联赛2023-01-04
- 【世界新要闻】与UzAuto合作,比亚迪在乌兹2023-01-04
- 广州车展实拍2023款奥迪A4L,配置升级,外2023-01-04
- 最高奖补1500元!员工来厦就业礼包再升级_2023-01-04
- 集中全院力量支持急诊 保障急危重症患者救2023-01-04
- 一批重大工程有序推进 助力中国经济稳健前2023-01-04
- 元旦假期全国邮政快递业揽投快递包裹超21.32023-01-04
- 快递业迎来春节高峰 上海快递运力持续恢复2023-01-04
- 环球观察:中国疾控中心:短期内XBB系列变2023-01-04
- 紧“药”关头,极目新闻携手爱心企业免费赠2023-01-04
- 天天热讯:一女子突发紧急腹痛 没曾想月经2023-01-04
- 用心守护,全力以赴!亚心医院多举措保障危2023-01-04